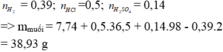Những câu hỏi liên quan
cho 8,8 gam hôn hợp gồm Mg và MgO tác dụng vừa đủ với dung dịch HCl 14,6 % cô cạn dung dịch sau phản ứng thu được 28,5 gam muối khan .
a, Tính % về khối lượng của từng chất trong hôn hợp ?
b, Tính khối lượng dung dịch HCl đa tham gia phản ứng ?
c, Tính nồng độ phần trăm của muối tạo thành sau phản ứng ?
Gọi x, y tương ứng là số mol Mg và MgO: 24x + 40y = 8,8.
x + y = nMgCl2 = 28,5/95 = 0,3
Giải hệ thu được: x = 0,2; y = 0,1.
a) %Mg = 24.0,2/8,8 = 54,54%; %MgO = 100 - 54,54 = 45,46%
b) nHCl = 2(x+y) = 0,6 mol; mdd =36,5.0,6.100/14,6 = 150 gam.
c) mdd sau p.ư = 8,8 + 150 - mH2 = 158,8 - 2.0,2 = 158,4 gam.
%MgCl2 = 28,5/158,4 = 17,99%
Đúng 0
Bình luận (0)
Hoà tan 5,1 gam hh Mg,Al vào dd HCl 2M dư sau phản ứng thu được dd X và 5,6 lít khí (đkc) a. Tính % khối lượng mỗi kim loại b. Tính V dd HCl 2M đã phản ứng ?
\(Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}24a+27b=5,1\\22,4a+22,4.1,5.b=5,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ a,\Rightarrow\%m_{Mg}=\dfrac{0,1.24}{5,1}.100\approx47,059\%\\ \Rightarrow\%m_{Al}\approx100\%-47,059\%\approx52,941\%\\ b,n_{HCl}=2.n_{H_2}=2.\left(0,1+0,1.1,5\right)=0,5\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)
Đúng 4
Bình luận (0)
a)\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
x 2x x x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y 3y y 1,5y
Ta có hệ:
\(\left\{{}\begin{matrix}24x+27y=5,1\\x+1,5y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{0,1\cdot24}{5,1}\cdot100\%=47,06\%\)
\(\%m_{Al}=100\%-47,06\%=52,94\%\)
b)\(\Sigma n_{HCl}=2x+3y=2\cdot0,1+3\cdot0,1=0,5mol\)
\(V=\dfrac{n}{C_M}=\dfrac{0,5}{2}=0,25l=250ml\)
Đúng 4
Bình luận (0)
Cho a gam Fe hòa tan trong dd HCl (TN1). Sau khi cô cạn dd thu được 3,1gam chất rắn. Nếu cho a gam Fe và b gam Mg (TN2) vào dd HCl (cũng với lượng như trên). Sau khi cô cạn dd thu được 3.34gam chất rắn và 448ml khí hidro. Tính a,b và khối lượng các muối.
Ở phản ứng 2 số mol H2 là nH2 = 0.448 / 22.4 = 0.02 mol Mg sẽ tham gia phản ứng trước
Mg + 2HCl = MgCl2+ H2
Fe + 2HCl = FeCl2 + H2
Nếu HCl ở phản ứng này vừa đủ hoặc dư thì ở phản ứng 1 chắc chắn sẽ dư. Do đó trong 3.34 gam chất rắn này sẽ có 3.1 gam FeCl2 và 0.24 gam MgCl2.-> n Fe = nFeCl2 = 3.1 / 127 >0.02 mol trong khi số mol H2 thu được của cả Mg và Fe tham gia phản ứng mới chỉ có 0.02 mol- không thỏa mãn. Như vậy trong phản ứng thứ 2 này. HCl đã thiếu -> số mol HCl có trong dung dịch = 2 số mol H2 = 0.04 mol
Quay trở lại phản ứng 1. Nếu như HCl vừa đủ hoặc dư thì số mol muối FeCl2 tạo thành nhỏ hơn hoặc bằng 0.02 mol tức là khối lượng FeCl2 sẽ nhỏ hơn hoặc bằng 127. 0.02= 2.54 gam. Trong khi thực tế lượng FeCl2 thu được là 3.1 gam. Do vậy HCl thiếu trong cả 2 phản ứng.
Trong phản ứng đầu tiên số mol FeCl2 = 1/2 n HCl = 0.04/2 = 0.02 mol -> khối lượng FeCl2 = 127.0,02 = 2.54 gam-> khối lượng Fe dư bằng 0.56 gam
-> a = 0.56 + 0.02 . 56 = 1.68 gam
Do cả 2 phản ứng đều thiếu HCl nên toàn bộ 0.04 mol Cl- sẽ tham gia tạo muối. Áp dụng định luật bảo toàn khối lượng -> khối lượng của Mg là b = 3.34 - 3.1 = 0.24 gam .
Tới đây là ra kết quả rồi. Có thể làm theo cách này nếu như không áp dụng định luật bảo toàn khối lượng
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol. Fe còn nguyên không phản ứng. Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi trên thực tế là 3.34 gam. Không thỏa mãn. Vậy có thể kết luận là Mg đã phản ứng hết và Fe phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
-> Hệ
95b/24 + 71x = 1.66
b/24 + x = 0.02 hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68
b = 0.24
Đúng 0
Bình luận (4)
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol. Fe còn nguyên không phản ứng. Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi trên thực tế là 3.34 gam. Không thỏa mãn. Vậy có thể kết luận là Mg đã phản ứng hết và Fe phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
-> Hệ
95b/24 + 71x = 1.66
b/24 + x = 0.02 hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68
b = 0.24
Đúng 0
Bình luận (4)
Xét TN1:
PTHH: Fe + 2HCl ⟶ FeCl2 + H2 (1)
Giả sử: Fe phản ứng hết →Chất rắn là FeCl2
nFe = nFeCl2 = nH2 = 3,1 : 127 ≈ 0,024 ( mol )
Xét TN2:
PTHH: Mg + 2HCl ⟶ MgCl2 + H2 (2)
Fe + 2HCl ⟶ FeCl2 + H2 (3)
Ta thấy: Ngoài a gam Fe như thí nghiệm 1 cộng với b gam Mg mà chỉ giải phóng:
nH2 = 0,448 : 22,4 = 0,02 ( mol ) < 0,024 (mol)
Chứng tỏ: Trong TN1: Fe dư, HCl hết.
TN1:
nFe(pư) = nFeCl2= 1212* nHCl = 0,04 : 2 = 0,02(mol)
⇒ mFe(dư) = 3,1 – 0,02 * 127 = 0,56 (gam)
mFe(pư) = 0,02 * 56 = 1,12(gam)
⇒ mFe = a = 0,56 + 1,12 = 1,68(gam)
*TN2: Áp dụng ĐLBTKL:
a + b = 3,34 + 0,02 * 2 - 0,04 *36,5 = 1,92 (g)
Mà a = 1,68g ⇒ b = 1,92 - 1,68 = 0,24 (g)
nMg = 0,24 : 24 = 0,01 (mol)
Theo PTHH (1) nH2 (1) = nMgCl2 = nMg = 0,01 (mol)
⇒ mMgCl2 = 0,01.95 = 0,95 (g)
⇒ nH2 (2) = 0,02 - 0,01 = 0,01 ( mol )
Theo (2) ⇒ nFeCl2 = nH2 (2) = 0,01 (mol)
⇒ mFeCl2 = 0,01 * 127 = 1,27 (g)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hoà tan 18,4 gam hỗn hợp 2 kim loại hoá trị II và III bằng axit HCl thu được dung dịch A + khí B. Chia đôi B.a) Phần B1 đem đốt cháy thu được 4,5 gam H2O. Hỏi cô cạn dd A thu được bao nhiêu gam muối khan.b) Phần B2 tác dụng hết clo và cho sản phẩm hấp thụ vào 200 ml dung dịch NaOH 20% (d 1,2). Tìm C% các chất trong dung dịch tạo ra.c) Tìm 2 kim loại, nếu biết tỉ số mol 2 muối khan 1 : 1 và khối lượng mol của kim loại này gấp 2,4 lần khối lượng mol của kim loại kia
Đọc tiếp
Hoà tan 18,4 gam hỗn hợp 2 kim loại hoá trị II và III bằng axit HCl thu được dung dịch A + khí B. Chia đôi B.
a) Phần B1 đem đốt cháy thu được 4,5 gam H2O. Hỏi cô cạn dd A thu được bao nhiêu gam muối khan.
b) Phần B2 tác dụng hết clo và cho sản phẩm hấp thụ vào 200 ml dung dịch NaOH 20% (d = 1,2). Tìm C% các chất trong dung dịch tạo ra.
c) Tìm 2 kim loại, nếu biết tỉ số mol 2 muối khan = 1 : 1 và khối lượng mol của kim loại này gấp 2,4 lần khối lượng mol của kim loại kia
- Gọi X, Y lần lượt là kim loại hóa trị II và III
X+2HCl\(\rightarrow\)XCl2+H2(1)
2Y+6HCl\(\rightarrow\)2YCl3+3H2(2)
Câu a:
- Phần B1: 2H2+O2\(\rightarrow\)2H2O
\(n_{H_2}=n_{H_2O}=\dfrac{4,5}{18}=0,25mol\)\(\rightarrow\)\(n_{H_2\left(B\right)}=2.0,25=0,5mol\)
Theo PTHH 1+2 ta có: \(n_{HCl}=2n_{H_2}=2.0,5=1mol\)
bảo toàn khối lượng:18,4+1.36,5=mmuối khan+0,5.2
mmuối khan=53,9 gam
Đúng 0
Bình luận (0)
Câu b:
H2+Cl2\(\rightarrow\)2HCl
HCl+NaOH\(\rightarrow\)NaCl+H2O
\(n_{HCl}=2n_{H_2}=2.0,25=0,5mol\)
\(n_{NaOH}=\dfrac{200.1,2.20}{40.100}=1,2mol\)
Dựa theo tỉ lệ mol có trong PTHH ta thấy NaOH dư=1,2-0,5=0,7 mol
nNaCl=nHCl=0,5mol
mdd=0,5.36,5+200.1,2=258,25g
\(C\%_{NaOH}=\dfrac{0,7.40.100}{258,25}\approx10,84\%\)
\(C\%_{NaCl}\dfrac{0,5.58,5.100}{258,25}\approx11,33\%\)
Đúng 0
Bình luận (0)
- Dựa vào PTHH 1 và 2 ta thấy số mol 2 muối bằng nhau đồng nghĩa với số mol 2 kim loại bằng nhau.Gọi số mol mỗi kim loại là a
(X+Y)a=18,4
\(n_{H_2}=a+1,5a=0,5\)\(\rightarrow\)2,5a=0,5\(\rightarrow\)a=0,2 mol
\(\rightarrow\)X+Y=18,4:0,2=92
- Nếu X=2,4Y ta có: 3,4Y=92 suy ra Y=92:3,4\(\approx\)27(Al: phù hợp) suy ra X=2,4.27\(\approx\)65(Zn: phù hợp)
- Nếu Y=2,4X ta có: 3,4X=92 suy ra X=92:3,4\(\approx\)27(Al: hóa trị III không đúng với đề bài X là kim loại hóa trị II)
Vậy X là Zn và Y là Al
Đúng 0
Bình luận (0)
Cho a gam Fe hoà tan trong dd HCl, (Thí nghiệm 1) sau khi cô cạn dung dịch thu được 3,1 gam chất rắn. Nếu cho a gam Fe và b gam Mg(Thí nghiệm 2) vào dd HCl ( cùng với lượng như trên). Sau khi cô cạn dung dịch thì thu được 3,34 gam chất rắn và 448ml H2(đktc). Tính a,b và khối lượng các muối.
Mọi người giúp mk nha. Cảm ơn trước.
Hóa ak bn!!!
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol.
Fe còn nguyên không phản ứng.
Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi trên thực tế là 3.34 gam.
Không thỏa mãn.
Vậy có thể kết luận là Mg đã phản ứng hết và Fe phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
=> Hệ 95b/24 + 71x = 1.66 b/24 + x = 0.02
hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68; b = 0.24
Đúng 0
Bình luận (0)
Ở phản ứng 2 số mol H2 là nH2 = 0.448 / 22.4 = 0.02 mol Mg sẽ tham gia phản ứng trước
Mg + 2HCl = MgCl2+ H2
Fe + 2HCl = FeCl2 + H2
Nếu HCl ở phản ứng này vừa đủ hoặc dư thì ở phản ứng 1 chắc chắn sẽ dư. Do đó trong
3.34 gam chất rắn này sẽ có 3.1 gam FeCl2 và 0.24 gam MgCl2.-> n Fe = nFeCl2 = 3.1 / 127
>0.02 mol trong khi số mol H2 thu được của cả Mg và Fe tham gia phản ứng mới chỉ có
0.02 mol- không thỏa mãn. Như vậy trong phản ứng thứ 2 này. HCl đã thiếu -> số mol HCl
có trong dung dịch = 2 số mol H2 = 0.04 mol
Quay trở lại phản ứng 1. Nếu như HCl vừa đủ hoặc dư thì số mol muối FeCl2 tạo thành nhỏ
hơn hoặc bằng 0.02 mol tức là khối lượng FeCl2 sẽ nhỏ hơn hoặc bằng 127. 0.02= 2.54
gam. Trong khi thực tế lượng FeCl2 thu được là 3.1 gam. Do vậy HCl thiếu trong cả 2 phản
ứng.
Trong phản ứng đầu tiên số mol FeCl2 = 1/2 n HCl = 0.04/2 = 0.02 mol -> khối lượng FeCl2
= 127.0,02 = 2.54 gam-> khối lượng Fe dư bằng 0.56 gam
-> a = 0.56 + 0.02 . 56 = 1.68 gam
Do cả 2 phản ứng đều thiếu HCl nên toàn bộ 0.04 mol Cl- sẽ tham gia tạo muối. Áp dụng
định luật bảo toàn khối lượng -> khối lượng của Mg là b = 3.34 - 3.1 = 0.24 gam .
Tới đây là ra kết quả rồi. Có thể làm theo cách này nếu như không áp dụng định luật bảo
toàn khối lượng
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol. Fe còn nguyên không phản
ứng. Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi
trên thực tế là 3.34 gam. Không thỏa mãn. Vậy có thể kết luận là Mg đã phản ứng hết và Fe
phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
-> Hệ
95b/24 + 71x = 1.66
b/24 + x = 0.02 hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68
b = 0.24
Đúng 0
Bình luận (0)
cho a gam Fe hòa tan trong dd HCl (TN1) sau khi cô cạn dd thu được 3,1 gam chất rắn. Nếu cho a gam Fe và b gam Mg (TN2) vào dd HCl cũng với lượng như trên sau khi cô cạn dd thì thu được 3,34 gam chất rắn và 448 ml khí H2 đktc. Tính a,b và khối lượng các muối
* Nếu trong TN2, kim loại không tan hết
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
=> nHCl = 0,04 (mol)
- Xét TN1:
- Nếu kim loại tan hết
\(n_{FeCl_2}=\dfrac{3,1}{127}=\dfrac{31}{1270}\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
\(\dfrac{31}{1270}\)<-\(\dfrac{31}{635}\)<----\(\dfrac{31}{1270}\)
Vô lí do \(\dfrac{31}{635}>0,04\)
=> Fe dư
PTHH: Fe + 2HCl --> FeCl2 + H2
0,02<-0,04---->0,02
=> \(m_{FeCl_2}=0,02.127=2,54\left(g\right)\)
=> \(m_{Fe\left(dư\right)}=3,1-2,54=0,56\left(g\right)\)
=> \(a=0,56+0,02.56=1,68\left(g\right)\)
- Xét TN2:
Theo ĐLBTKL: a + b + 0,04.36,5 = 3,34 + 0,02.2
=> a + b = = 1,92 (g)
=> b = 0,24 (g)
\(n_{Mg}=\dfrac{0,24}{24}=0,01\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,01-------------->0,01-->0,01
Fe + 2HCl --> FeCl2 + H2
0,01<-------------0,01<--0,01
=> \(\left\{{}\begin{matrix}m_{MgCl_2}=0,01.95=0,95\left(g\right)\\m_{FeCl_2}=0,01.127=1,27\left(g\right)\end{matrix}\right.\)
* Nếu trong TH2, kim loại tan hết
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
PTHH: Mg + 2HCl --> MgCl2 + H2
x----------------->x------>x
Fe + 2HCl --> FeCl2 + H2
y----------------->y---->y
=> \(\left\{{}\begin{matrix}95x+127y=3,34\\x+y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=-0,025\\y=0,045\end{matrix}\right.\) (vô lí)
Đúng 3
Bình luận (0)
Hoà tan hết 7,74 gam hh bột Mg, Al bằng 500 ml dd hh HCl 1M và H2SO4 0,28M thu được dd X và 8,736 lít khí H2 (ở đktc). Cô cạn dd X thu được lượng muối khan là A. 38,93 gam. B. 103,85 gam. C. 25,95 gam. D. 77,86 gam.
Đọc tiếp
Hoà tan hết 7,74 gam hh bột Mg, Al bằng 500 ml dd hh HCl 1M và H2SO4 0,28M thu được dd X và 8,736 lít khí H2 (ở đktc). Cô cạn dd X thu được lượng muối khan là
A. 38,93 gam.
B. 103,85 gam.
C. 25,95 gam.
D. 77,86 gam.
Cho 13,2g hh Mg và Fe tác dụng với lượng dư dd HCl,sau phản ứng thu được dd X và 7,84 lít khí H2( đktc)
a) Viết phương trình phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
b) Cô cạn dung dịch X thu được m gam muối khan.Tính m
mn giúp em với
Xem chi tiết
nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
Đúng 1
Bình luận (0)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)
Đúng 1
Bình luận (0)
Cho 13,2g hh Mg và Fe tác dụng với lượng dư dd HCl,sau phản ứng thu được dd X và 8,6765
lít khí H2( đktc) a) Viết phương trình phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu b) Cô cạn dung dịch X thu được m gam muối khan.Tính mSửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)
Đúng 2
Bình luận (0)